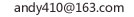二价铁离子 三价铁离子 Fe的电子排布式 和 价层电子排布式~
二价铁离子的电子排布式:1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶
三价铁离子的电子排布式:1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁵
因为三价铁离子比二价铁离子多失一个电子,所以二价铁离子是3d⁶,三价铁离子3d⁵
铁元素是26号元素,二价铁离子核外是24个电子,三价铁离子核外是23个电子。
扩展资料:
表示原子核外电子排布的图式之一。有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。如钠原子的电子排布1s² 2s² 2p⁶ 3s¹ 。迄今为止,只发现了7个电子层。
用能级的符号及能级中容纳电子数值表达核外电子运动的状态。
电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示,以简化电子排布式。以稀有气体的元素符号加方括号的部分称为“原子实”。
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守泡利不相容原理和洪特规则及其补充规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
参考资料来源:百度百科-电子排布式
#17770412858#
三价铁离子的最外层电子数是多少急!!!!!! ******
#巫竹# 铁的核外电子排布为2,8,14,2,三价铁失去最外层电子,以及一个次外层电子,所以现在的最外层有13个电子.
#17770412858#
Fe正三价离子的电子排布式是不是违反了构造原理排布式为[Ar]3d5 按照构造原理不应该先排4s吗,构造原理才是电子排布的核心原理.构造原理应该优先吧 - ******
#巫竹#[答案] 失去电子,和电子排布,是没有直接关系的. 铁先失去最外层的两个电子, 在吸引电子能力更强的时候,再失去次外层(其实这个时候是最外层)的一个电子 根据构造原理,此时为3d6 再失去一个 形成3d5 构成一个半满.更加稳定.
#17770412858#
三价铁离子的电子构型 - ******
#巫竹# 属于9~17电子构型,fe的外层电子分布式是3d64s2,变成三价的铁离子后,电子分布变为3d5,那么根据离子的外电子层电子分布通式,ns2,np6,nd1~9可知,铁离子的为3s2,3p6,3d5,则3+6+5=14,14在9~17的范围内,所以是9~17电子构型.看完了记得采纳,点赞哦~谢谢亲~
#17770412858#
铁离子的电子排布式为何是[Ar]3d5 - ******
#巫竹#[答案] 铁原子失去最外层的两个电子4s2时就是亚铁离子,在失去3d6中的一个电子,使d亚层达到半满状态,变成3d5就是铁离子,而前面的电子层1s2 2s2 2p6 3s2 3p6是Ar原子的电子排布,可以表示为[Ar],就是说[Ar]=1s2 2s2 2p6 3s2 3p6,铁离子1s2 2...
#17770412858#
请根据铁的电子排布解释其为什么有+3价 - ******
#巫竹#[答案] 核外电子排布 Fe:1s2 2s2 2p6 3s2 3p6 4s2 3d6填电子是先填4s,再填3d轨道,但失电子则先失去主量子数大的壳层的电子,即先失去4s轨道电子,再失去3d轨道电子失去4s的两个电子,最外层为3s2 3p6 3d6 这是二价铁的状态而三...
#17770412858#
铁的核外电子数为26,最外层的电子数为8,铁离子的符号为什么还是Fe3+Fe2+(初中化学) - ******
#巫竹#[答案] 因为铁原子最外层电子是2个,不是8个,铁容易失去2个电子,所以为+2价亚铁;失去三个电子,就为+3价铁离子. 再具体的,你可以上高一后学习核外电子排布的轨道式会有更多的了解.
#17770412858#
+3铁离子结构 - ******
#巫竹# 铁是26号元素,核外有26个电子.+3铁离子的核外有23个电子,这些电子的排列是:第一层有2个,即1S2,第二层有8个电子,即:2S22P6,第三层有13个电子,即3s23p63d5,由于3d电子层有5个电子,处于半饱和状态,这种状态的对称性很好,因此是一种稳定状态.正因为如此,+2铁离子很容易被氧化成+3铁离子.
#17770412858#
铁正3价的价电子排布式 - ******
#巫竹# 3d5